Eilmeldung: Skalierbarer Festkörperakku mit Vollladung in 5 Minuten auf der CES 2026 vorgestellt
| Jerry Huang
Neuigkeiten von der Consumer Electronics Show (CES) 2026 in Las Vegas: Das finnische Startup Donut Lab präsentierte auf der jährlichen CES-Messe sein bahnbrechendes „Black Tech“-Produkt – das Unternehmen behauptet, seine Batterie sei die weltweit erste in Serie gefertigte Festkörperbatterie (ASSB). Auf der CES 2026 kündigte Donut Lab die Markteinführung der nach eigenen Angaben weltweit ersten Festkörperbatterie an. Diese ist bereit für die OEM-Produktion und wird als erste Batterie in den Zweiradmodellen TS Pro und Ultra von Verge Motorcycles zum Einsatz kommen. Sollten die Batterien tatsächlich an Kunden ausgeliefert werden, wäre dies ein wichtiger Meilenstein auf dem Weg zur globalen Elektrifizierung und markiert den Übergang der Festkörpertechnologie vom Labor in die Serienproduktion.
Auf der CES 2026 kündigte Donut Lab die Markteinführung der nach eigenen Angaben weltweit ersten Festkörperbatterie an. Diese ist bereit für die OEM-Produktion und wird als erste Batterie in den Zweiradmodellen TS Pro und Ultra von Verge Motorcycles zum Einsatz kommen. Sollten die Batterien tatsächlich an Kunden ausgeliefert werden, wäre dies ein wichtiger Meilenstein auf dem Weg zur globalen Elektrifizierung und markiert den Übergang der Festkörpertechnologie vom Labor in die Serienproduktion. In einer Pressemitteilung auf seiner offiziellen Website erklärte Donut Lab, dass das Unternehmen sich der Entwicklung und Bereitstellung innovativer Elektrifizierungslösungen verschrieben hat, indem es die Leistungsgrenzen von Elektrofahrzeugen kontinuierlich erweitert und neue Technologien auf den Markt bringt. Donut Lab gestaltet die Zukunft der Mobilität. „Donut Lab freut sich, die weltweit erste Festkörperbatterie vorzustellen, die für die Erstausrüstung von Fahrzeugen geeignet ist. Die Festkörperbatterie von Donut Lab wird umgehend kommerziell eingesetzt und versorgt die bestehende Verge-Motorradpalette mit Energie.“
In einer Pressemitteilung auf seiner offiziellen Website erklärte Donut Lab, dass das Unternehmen sich der Entwicklung und Bereitstellung innovativer Elektrifizierungslösungen verschrieben hat, indem es die Leistungsgrenzen von Elektrofahrzeugen kontinuierlich erweitert und neue Technologien auf den Markt bringt. Donut Lab gestaltet die Zukunft der Mobilität. „Donut Lab freut sich, die weltweit erste Festkörperbatterie vorzustellen, die für die Erstausrüstung von Fahrzeugen geeignet ist. Die Festkörperbatterie von Donut Lab wird umgehend kommerziell eingesetzt und versorgt die bestehende Verge-Motorradpalette mit Energie.“
Berichten zufolge bietet die Festkörperbatterie von Donut Lab eine Energiedichte von 400 Wh/kg und ermöglicht so eine größere Reichweite, eine leichtere Bauweise und eine beispiellose Flexibilität beim Fahrzeug- und Produktdesign.
Der Akku kann in nur 5 Minuten vollständig aufgeladen werden, ohne dass eine Begrenzung des Ladezustands auf 80 % erforderlich ist, und er unterstützt eine sichere, wiederholte und zuverlässige vollständige Entladung.
Im Gegensatz zu herkömmlichen Lithium-Ionen-Akkus bietet dieser Festkörperakku über seine gesamte Lebensdauer einen minimalen Kapazitätsverlust. Er soll bis zu 100.000 Ladezyklen getestet haben und damit eine deutlich längere Lebensdauer als bestehende Technologien bieten. Sicherheit ist ein weiteres zentrales Merkmal: keine brennbaren flüssigen Elektrolyte, kein thermisches Durchgehen und keine Metalldendriten! Dadurch wird die Brandgefahr von Akkus grundsätzlich ausgeschlossen, was ihn extrem sicher und wahrhaft revolutionär macht. 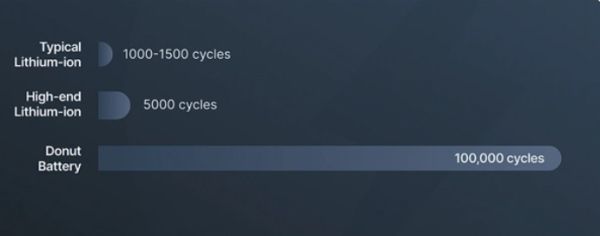 Donut Lab gab an, dass die Leistungsfähigkeit der Batterie bei Temperaturen von -30 bis über 100 Grad Celsius strengstens getestet wurde (wobei 99 Prozent der Kapazität erhalten blieben, ohne dass Anzeichen von Entzündung oder Zersetzung auftraten).
Donut Lab gab an, dass die Leistungsfähigkeit der Batterie bei Temperaturen von -30 bis über 100 Grad Celsius strengstens getestet wurde (wobei 99 Prozent der Kapazität erhalten blieben, ohne dass Anzeichen von Entzündung oder Zersetzung auftraten).
Donut Lab gibt hinsichtlich Rohstoffen und Kosten an, dass seine Festkörperbatterien vollständig aus „reichlich vorhandenen, erschwinglichen und geopolitisch sicheren Materialien“ bestehen, frei von seltenen Elementen sind und weniger kosten als Lithium-Ionen-Alternativen. Donut Lab spezifiziert jedoch nicht die spezifischen Materialien, die für die Herstellung seiner Festkörperbatteriezelle benötigt werden.
Antuan Goodwin, ein erfahrener Journalist der Automobilindustrie, konnte auf der diesjährigen CES das Festkörperbatteriemodell von Donut Lab genauer unter die Lupe nehmen. Seinen Ausführungen zufolge ist die Batterie ähnlich groß wie ein Smartphone mit großem Bildschirm (beispielsweise das iPhone 17 Pro Max) und dabei extrem leicht. Diese ultraleichte Batterie eignet sich daher zukünftig hervorragend für den Einsatz in Drohnen.
Donut Lab plant, eine Lösung zu entwickeln, um diese Batterien zu größeren 5-kWh-Akkus zu kombinieren. Jeder Akku hat eine ähnliche Größe wie die PS5-Spielkonsole. Dank ihrer geringen Größe können vier dieser Akkus im Rahmen des Motorrads Verge TS Pro verbaut werden. Dieses innovative Design profitiert von einem kreisförmigen Elektromotor, der in das Rad integriert ist und von Donut Lab im letzten Jahr angekündigt wurde. Donut Lab und Verge Motorcycles gaben am Montag bekannt, dass Verge Motorcycles als weltweit erstes Serienfahrzeug mit dieser neuen Batterie ausgestattet sein wird. Das Motorrad zeichnet sich durch eine Ladezeit von nur 10 Minuten aus und bietet eine Reichweite von bis zu 60 Kilometern pro Lademinute. Die Version Verge Ultra schafft sogar bis zu 600 Kilometer mit einer einzigen Ladung. Die Lebensdauer der Batterie von 100.000 Ladezyklen entspricht einer theoretischen Gesamtreichweite von 60 Millionen Kilometern. Selbst bei einer jährlichen Fahrleistung von 60.000 Kilometern könnte die Batterie theoretisch 1.000 Jahre halten. Manche sagen, das klingt „zu schön, um wahr zu sein“.
Donut Lab und Verge Motorcycles gaben am Montag bekannt, dass Verge Motorcycles als weltweit erstes Serienfahrzeug mit dieser neuen Batterie ausgestattet sein wird. Das Motorrad zeichnet sich durch eine Ladezeit von nur 10 Minuten aus und bietet eine Reichweite von bis zu 60 Kilometern pro Lademinute. Die Version Verge Ultra schafft sogar bis zu 600 Kilometer mit einer einzigen Ladung. Die Lebensdauer der Batterie von 100.000 Ladezyklen entspricht einer theoretischen Gesamtreichweite von 60 Millionen Kilometern. Selbst bei einer jährlichen Fahrleistung von 60.000 Kilometern könnte die Batterie theoretisch 1.000 Jahre halten. Manche sagen, das klingt „zu schön, um wahr zu sein“.
„Donut Lab hat eine neue, leistungsstarke Festkörperbatterie in Donut-Bauweise entwickelt, die sich für die Massenproduktion eignet und ab dem ersten Quartal 2026 in den Motorrädern von Verge Motorcycles im realen Einsatz zu sehen sein wird.“ Der Preis für die Verge TS Pro beginnt bei 29.900 US-Dollar. Neben dem Einsatz in Elektromotorrädern ist die Festkörperbatterie offensichtlich vielversprechender für den Einsatz in Elektrofahrzeugen. Goodwin erklärte, dass die Vorteile dieser Technologie bei größeren Fahrzeugen besonders deutlich zum Tragen kommen – die Gewichtsreduzierung und die verbesserte Ladegeschwindigkeit würden sich im Gebrauch verdoppeln. Donut Lab gab am Montag bekannt, mit dem Elektrofahrzeughersteller WattEV zusammenzuarbeiten, um eine ultraleichte, modulare Elektrofahrzeugplattform zu entwickeln, die die Motor- und Batterietechnologie von Donut kombiniert.
Neben dem Einsatz in Elektromotorrädern ist die Festkörperbatterie offensichtlich vielversprechender für den Einsatz in Elektrofahrzeugen. Goodwin erklärte, dass die Vorteile dieser Technologie bei größeren Fahrzeugen besonders deutlich zum Tragen kommen – die Gewichtsreduzierung und die verbesserte Ladegeschwindigkeit würden sich im Gebrauch verdoppeln. Donut Lab gab am Montag bekannt, mit dem Elektrofahrzeughersteller WattEV zusammenzuarbeiten, um eine ultraleichte, modulare Elektrofahrzeugplattform zu entwickeln, die die Motor- und Batterietechnologie von Donut kombiniert.
„Festkörperbatterien wurden immer als ‚in wenigen Jahren marktreif‘ beschrieben“, sagte Marko Lehtimäki, Geschäftsführer von Donut Lab. „Unsere Antwort ist anders. Sie sind schon heute marktreif. Nicht erst später.“
Zum besseren Verständnis betrachten wir die aktuell im Handel erhältlichen Batterien und die Pläne für die Massenproduktion ihrer Festkörperbatterien. In der Batterieindustrie existiert seit jeher das „Mundellsche Trilemma“ oder die „Unmögliche Dreifaltigkeit“, die die Schwierigkeit beschreibt, die drei Kernindikatoren von Batterien (Leistung, Kosten und Sicherheit) gleichzeitig in Einklang zu bringen. Die Optimierung eines dieser Indikatoren erfordert oft die Beeinträchtigung eines oder sogar zweier anderer.
Im Vergleich dazu liegt die Energiedichte handelsüblicher Lithium-Ionen-Akkus bei etwa 250 bis 300 Wh/kg, mit einer typischen Lebensdauer von rund 5000 Ladezyklen. Um die Lebensdauer zu verlängern, wird oft empfohlen, die Akkus nicht über 80 % aufzuladen. Sollten alle Angaben zum Donut-Akku zutreffen, übertrifft er die bestehende Technologie in praktisch jeder Hinsicht.
Sunwoda kündigte im Oktober 2025 eine neue Generation von Polymer-Festkörperbatterien mit einer Energiedichte von 400 Wh/kg an, die jedoch nur 1200 Ladezyklen erreicht. Die zweite Generation der Shenxing-Superbatterie von CATL, die im April 2025 auf den Markt kam, ist ebenfalls kommerziell erhältlich und ermöglicht eine Reichweite von 520 Kilometern bei einer Ladezeit von 5 Minuten. Die Lebensdauer der LFP-Batterie der fünften Generation liegt bei über 3000 Ladezyklen.
Toyota plante ursprünglich die Massenproduktion seiner Festkörperbatterie im Jahr 2020, verschob den Termin jedoch später auf 2023, dann auf 2026 und nun auf 2027-2028. Auch Samsung SDI hat sich das Ziel gesetzt, eine skalierbare Festkörperbatterie im Jahr 2027 auf den Markt zu bringen.
CATL plant, die Kleinserienproduktion von Festkörperbatterien im Jahr 2027 und die Großserienproduktion um 2030 aufzunehmen. Hyundai und Kia gehen davon aus, dass dies nicht vor 2030 der Fall sein wird. Bloomberg NEF prognostiziert, dass Festkörperbatterien selbst im Jahr 2035 nur einen globalen Marktanteil von etwa 10 % bei Elektrofahrzeugen und Energiespeichern erreichen werden.