Nyhet: Skalbart solid state-batteri för full laddning på 5 minuter presenteras på CES 2026
| Jerry Huang
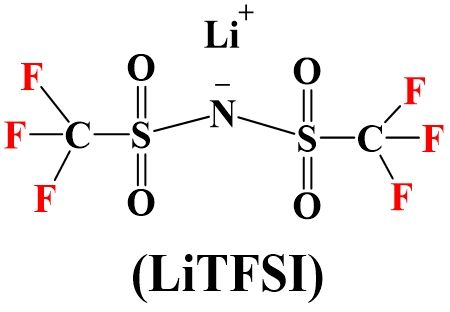
Nyheter från Consumer Electronics Show (CES) 2026 i Las Vegas. Den finska startupen Donut Lab visade upp sin explosiva "black tech"-produkt på den årliga CES-utställningen – företaget hävdar att deras batteri är världens första massproducerade hel-solid-state-batteri (ASSB). Vid CES-utställningen 2026 tillkännagav Donut Lab lanseringen av vad de kallar världens första heltäckande solid-state-batteri, vilket är redo för OEM-produktion och kommer att vara den första typen som används på Verge Motorcycles TS Pro och Ultra, tvåhjuliga motorcykelmodeller. Om de verkligen levereras till kunder kommer detta att vara en viktig milstolpe i den globala elektrifieringsvägen, som markerar övergången för solid-state-teknik från laboratorie- till massproduktionsmodeller.
Vid CES-utställningen 2026 tillkännagav Donut Lab lanseringen av vad de kallar världens första heltäckande solid-state-batteri, vilket är redo för OEM-produktion och kommer att vara den första typen som används på Verge Motorcycles TS Pro och Ultra, tvåhjuliga motorcykelmodeller. Om de verkligen levereras till kunder kommer detta att vara en viktig milstolpe i den globala elektrifieringsvägen, som markerar övergången för solid-state-teknik från laboratorie- till massproduktionsmodeller. I ett pressmeddelande på sin officiella webbplats uppgav Donut Lab att de är engagerade i att förnya och leverera nya former av elektrifieringslösningar genom att ständigt tänja på gränserna för elfordons prestanda och introducera ny teknik på marknaden. Donut Lab formar framtidens mobilitet. "Nu är Donut Lab hedrade att lansera världens första solid state-batteri som kan användas för OEM-fordonstillverkning. Donut Labs solid state-batteri kommer omedelbart att tas i kommersiell tillämpning och förse det befintliga sortimentet av Verge-motorcyklar med kraft."
I ett pressmeddelande på sin officiella webbplats uppgav Donut Lab att de är engagerade i att förnya och leverera nya former av elektrifieringslösningar genom att ständigt tänja på gränserna för elfordons prestanda och introducera ny teknik på marknaden. Donut Lab formar framtidens mobilitet. "Nu är Donut Lab hedrade att lansera världens första solid state-batteri som kan användas för OEM-fordonstillverkning. Donut Labs solid state-batteri kommer omedelbart att tas i kommersiell tillämpning och förse det befintliga sortimentet av Verge-motorcyklar med kraft."
Enligt rapporter ger Donut Labs heltäckande solid-state-batteri en energitäthet på 400 Wh/kg, vilket möjliggör längre räckvidd, lättare struktur och oöverträffad flexibilitet i fordons- och produktdesign.
Batteriet kan laddas helt på bara 5 minuter utan att laddningen behöver begränsas till 80 %, och det stöder säker, upprepad och pålitlig fullständig urladdning.
Till skillnad från traditionella litiumjonbatterier erbjuder detta heltäckande solid-state-batteri "minimal kapacitetsminskning" under sin livslängd. Det sägs ha testat upp till 100 000 laddningscykler, vilket ger en faktisk livslängd som långt utöver befintlig teknik. Säkerhet är en annan kärna i dess funktioner: inga brandfarliga flytande elektrolyter, ingen termisk rusning och inga metalldendriter! Detta eliminerar i grunden orsaken till batteribränder, vilket gör det extremt säkert och verkligt revolutionerande. 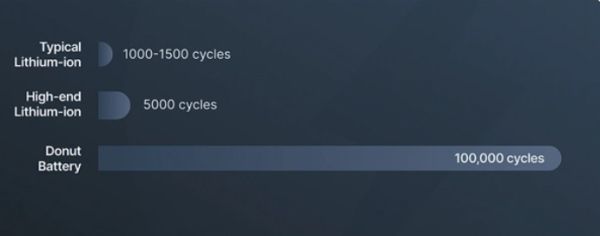 Donut Lab uppgav att batteriets prestanda har testats rigoröst i temperaturer från -30 till över 100 grader C (med bibehållen 99 procents kapacitet "utan tecken på antändning eller nedbrytning").
Donut Lab uppgav att batteriets prestanda har testats rigoröst i temperaturer från -30 till över 100 grader C (med bibehållen 99 procents kapacitet "utan tecken på antändning eller nedbrytning").
När det gäller råmaterial och kostnader uppger Donut Lab att deras solid state-batterier är helt tillverkade av "rikliga, prisvärda och geopolitiskt säkra material", fria från sällsynta ämnen, och kostar mindre än litiumjonalternativ. Donut Lab specificerar dock inte de specifika material som krävs för att producera deras solid state-battericell.
Antuan Goodwin, en erfaren journalist inom bilbranschen, har på årets CES-mässa haft ett nära möte med Donut Labs solid-state-batterimodell. Enligt hans presentation är batteristorleken liknande en storskärmssmartphone (som iPhone 17 Pro Max), och den är extremt lätt. Detta ultralätta batteri kommer också att vara mycket lämpligt för användning i drönare i framtiden.
Enligt sin plan ska Donut Lab bygga en lösning för att kombinera dessa batterier till större 5 kWh-kraftenheter; och varje enhet är av liknande storlek som spelkonsolen PS5. Dess lilla storlek möjliggör installation av fyra sådana kraftenheter i ramen på motorcykeln Verge TS Pro. Denna banbrytande design drar nytta av en cirkulär elmotor integrerad i hjulet som Donut Lab tillkännagav förra året. Donut Lab och Verge Motorcycles meddelade på måndagen att Verge motorcyklar kommer att bli världens första massproducerade fordon utrustat med detta nya batteri. Motorcykeln har en laddningstid på endast 10 minuter, vilket ger en räckvidd på upp till 60 kilometer per minut. Och deras version Verge Ultra kan färdas upp till 600 kilometer på en enda laddning. En livslängd på 100 000 cykler för detta batteri kan tolkas som en teoretisk total räckvidd på 60 miljoner kilometer. Även om det körs 60 000 kilometer per år kan detta batteri teoretiskt sett hålla i 1000 år. Vissa säger att detta låter "för bra för att vara sant".
Donut Lab och Verge Motorcycles meddelade på måndagen att Verge motorcyklar kommer att bli världens första massproducerade fordon utrustat med detta nya batteri. Motorcykeln har en laddningstid på endast 10 minuter, vilket ger en räckvidd på upp till 60 kilometer per minut. Och deras version Verge Ultra kan färdas upp till 600 kilometer på en enda laddning. En livslängd på 100 000 cykler för detta batteri kan tolkas som en teoretisk total räckvidd på 60 miljoner kilometer. Även om det körs 60 000 kilometer per år kan detta batteri teoretiskt sett hålla i 1000 år. Vissa säger att detta låter "för bra för att vara sant".
”Donut Lab har konstruerat ett nytt högpresterande solid state-batteri för Donut som kan skalas upp till stora produktionsvolymer och nu ses i verklig användning i Verge Motorcycles motorcyklar ute på vägarna under första kvartalet 2026.” Priset för Verge TS Pro börjar från 29 900 dollar. Förutom installation i elmotorcyklar är solid state-batterier uppenbarligen mer lovande för tillämpningar i elfordon. Goodwin uppgav att fördelarna med denna teknik är mer betydande i stora fordon - viktminskningen och förbättringen av laddningshastigheten kommer att visa en fördubblingseffekt vid användning. Donut Lab meddelade på måndagen att de kommer att samarbeta med elfordonsföretaget WattEV för att skapa en ultralätt modulär elfordonsplattform som kombinerar Donut-motor- och batteriteknik.
Förutom installation i elmotorcyklar är solid state-batterier uppenbarligen mer lovande för tillämpningar i elfordon. Goodwin uppgav att fördelarna med denna teknik är mer betydande i stora fordon - viktminskningen och förbättringen av laddningshastigheten kommer att visa en fördubblingseffekt vid användning. Donut Lab meddelade på måndagen att de kommer att samarbeta med elfordonsföretaget WattEV för att skapa en ultralätt modulär elfordonsplattform som kombinerar Donut-motor- och batteriteknik.
”Fastkroppsbatterier har alltid beskrivits som ’bara några år bort’”, säger Donut Labs VD Marko Lehtimäki. ”Vårt svar är annorlunda. De är redo idag. Inte senare.”
För att bättre förstå detta, låt oss ta en titt på de nuvarande batterierna som används kommersiellt och planerna för massproduktion av deras heltäckande solid state-batterier. Det har alltid funnits "(Mundellianska) trilemmat" eller "Den omöjliga treenigheten" inom batteriindustrin, vilket hänvisar till svårigheten att samtidigt balansera de tre kärnindikatorerna för batterier (prestanda, kostnad och säkerhet). Att optimera en av dem kräver ofta att man offra den andra eller till och med två.
Som jämförelse varierar energitätheten hos de bästa kommersiella litiumjonbatterierna från cirka 250 till 300 Wh/kg, med en typisk livslängd på cirka 5000 cykler. För att förlänga batteritiden rekommenderas det ofta inte att ladda dem högre än 80 %. Om alla funktioner hos Donut-batteriet är sanna, överträffar det i princip befintlig teknik i alla avseenden.
I oktober 2025 tillkännagav Sunwoda en ny generation polymer-fastkroppsbatteri med en energitäthet på 400 Wh/kg, vilket har en livslängd på endast 1200 cykler. Andra generationens Shenxing-superbatteri som släpptes av CATL i april 2025 har också kommersialiserats med en räckvidd på 520 kilometer på 5 minuters laddning. Livslängden för deras femte generationens LFP-batteri är ungefär över 3000 cykler.
Toyota planerade ursprungligen massproduktion av sitt heltäckande solid-state-batteri år 2020, men senare sköts det upp till 2023 och sedan till 2026, nu 2027-2028. Samsung SDI har också satt som mål att skaffa skalbara heltäckande solid-state-batterier år 2027.
CATL har en plan att deras småskaliga produktion av hel-solid state-batterier ska genomföras 2027 och storskalig omkring 2030. Hyundai och Kia säger att det inte kommer att ske tidigare än 2030. Bloomberg NEF förutspår att även år 2035 kommer alla solid state-batterier bara att ha cirka 10 % av den globala andelen från elfordon och energilagringsinstallationer.